
2025年9月28日,浦合醫藥自主研發并擁有完全知識產權的潛在Best-in-class WRN化藥1類小分子抑制劑PH027-1獲批IND,成為該靶點首個獲得完整臨床批件的國產小分子化合物。PH027-1是浦合醫藥第四個進入臨床階段的項目。
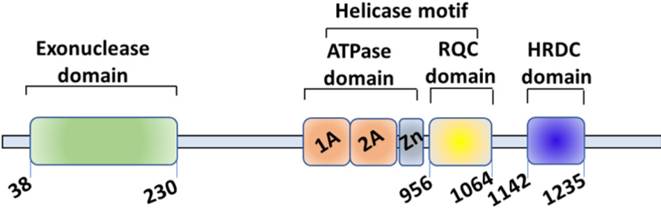
WRN是DNA解旋酶RecQ家族成員,為該家族中唯一擁有核酸外切酶結構域的蛋白。WRN位于染色體8p12,由34個外顯子組成。該蛋白有4個結構域,分別是位于N端區域的3'→5'核酸外切酶結構域、ATPase結構域、與DNA結合的RQC結構域和介導蛋白質相互作用的HRDC結構域。其中,ATPase結構域和RQC結構域是WRN發揮解旋酶功能的核心。WRN在維持基因組穩定性方面發揮重要作用,參與DNA復制、轉錄、修復及維持端粒穩定等生物學過程。WRN缺失會導致細胞周期停滯、DNA 損傷、有絲分裂缺陷、染色體破碎和細胞凋亡等。
WRN蛋白結構域和生物學功能【1】
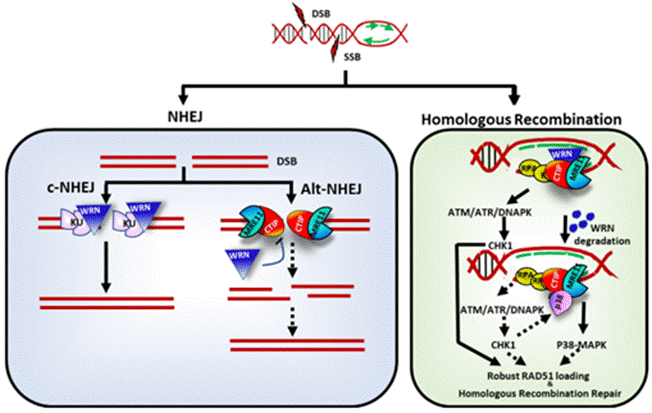
微衛星也稱為短串聯重復或簡單序列重復,由1-6個核苷酸的重復序列組成,約占基因組的3%。DNA錯配修復(MMR)系統廣泛存在于原核生物與真核生物中,是細胞進化中高度保守的DNA修復機制,對維持基因組的完整性和穩定性至關重要。由于腫瘤細胞內MMR系統存在缺陷,基因組容易發生重復序列的插入或缺失突變,導致微衛星序列復制錯誤大量積累,從而產生微衛星高度不穩定性(MSI-H)狀態。MSI-H為腫瘤細胞較為獨特的現象,可以導致腫瘤細胞基因組進一步紊亂和突變,從而促進惡性腫瘤的發生發展,是公認的重要致癌途徑之一。MSI-H在子宮內膜癌、胃癌、結直腸癌等多種癌種中普遍存在,發生率約為11~27%,該類患者往往對傳統化療類藥物反應較差,除免疫治療外,臨床仍亟需新的治療方式。
研究表明,MSI-H腫瘤細胞在敲除WRN基因或耗盡WRN蛋白后,會發生明顯合成致死效應,導致細胞死亡。且該合成致死現象與其他RecQ解旋酶無關,僅與WRN活性相關。這使得WRN成為MSI-H腫瘤的一個非常理想的治療靶點。目前,全球范圍內已有數款 WRN 抑制劑進入早期臨床研發階段,其中諾華、拜耳、GSK 等國際大藥企均已重點布局該靶點藥物,相關產品當前處于臨床 I/II 期階段,充分印證了 WRN 靶點的治療價值與研發潛力。浦合醫藥PH027-1 的IND獲批大幅縮短了國內藥企與國際MNC在該靶點上臨床階段的差距,展現出浦合醫藥在全球熱門靶點領域的競爭力。
WRN和MSI-H的合成致死關系【2】
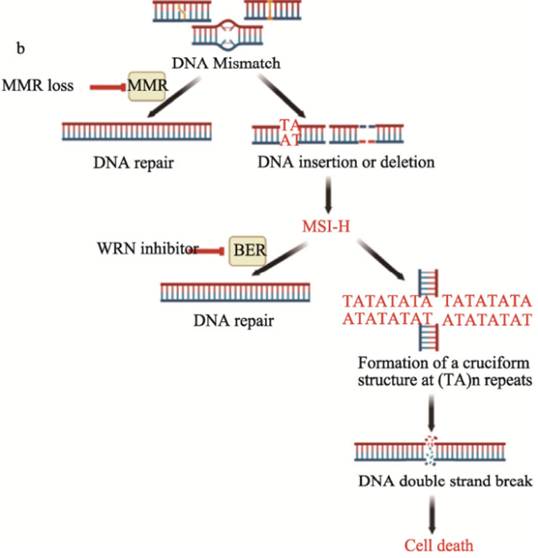
PH027-1在臨床前數據中展現出與MSI-H明顯的合成致死效應,且對MSI-H細胞具有強選擇性,預示該藥物未來在臨床的安全性潛力。此外,在動物實驗中PH027-1也展現了極佳的藥效及安全性。
未來,該藥物將在胃腸道腫瘤、子宮內膜癌等多種癌種中發揮作用,為MSI-H患者提供新的治療選擇。同時,該分子也可與免疫治療和化療等其他治療方案聯用,進一步提升其在MSI-H患者的治療療效,延長患者生存期。PH027-1的臨床試驗也在積極推進中。
參考文獻:
【1】Gupta P, Majumdar A G, Patro B S. Enigmatic role of WRN-RECQL helicase in DNA repair and its implications in cancer[J]. J. Transl. Genet. Genom, 2022, 6: 147-156.
【2】Van Wietmarschen N, Nathan W J, Nussenzweig A. The WRN helicase: Resolving a new target in microsatellite unstable cancers[J]. Curr Opin Genet Dev, 2021(71): 34-38.